A Anvisa suspendeu nesta segunda-feira (22/5) dois medicamentos da empresa Brainfarma Indústria Química e um da Cosmed Indústria de Cosméticos e Medicamento. Ao todo são 52 lotes suspensos por causa de uma avaliação da própria Brainfarma que identificou um desvio de qualidade em uma inspeção para investigar as boas práticas do seu laboratório de controle de qualidade. Os produtos interditados da Cosmed também são fabricados pela Brainfarma, ou seja, embora a Cosmed seja a proprietária e responsável pelos medicamentos, a linha de produção utilizada é a da Brainfarma. A ação é uma atualização da interdição anterior que a Anvisa havia…
Solução Clear Plus para micoses é proibida pela Anvisa
Anvisa determinou, nesta segunda-feira (22/5), a proibição do produto Clear Plus Solução Antimicótica – para unhas (micose) de 10ml. A solução é fabricada pela empresa Jose de Brito Daniel, que não possui cadastro ou Autorização de funcionamento (AFE) e comercializada irregularmente. A resolução RE 1.347 de 19 de maio de 2017, proíbe o medicamento clandestino de ser comercializado, divulgado, distribuído ou usado em todo o território nacional. Além disso, foi determinada a apreensão e inutilização de todas as unidades disponíveis no mercado. Quer saber as notícias da Anvisa em primeira mão? Siga-nos no Twitter (@anvisa_oficial)! Encontrou algum problema nesta…
Insuficiência cardíaca tem novo tratamento aprovado
Por: Ascom/Anvisa A Anvisa aprovou nesta segunda-feira (8/5), o medicamento Entresto® (sacubitril/valsartana). O medicamentos é inédito no Brasil. A insuficiência cardíaca ocorre quando o coração não é capaz de bombear o sangue de forma correta para o corpo. Essa condição é resultado de uma deficiência no enchimento do ventrículo. Mesmo com as terapias atualmente recomendadas pelas diretrizes clínicas nacionais e internacionais para o tratamento da insuficiência cardíaca, as taxas de mortalidade e de morbidade permanecem altas, com hospitalização frequente e baixa qualidade de vida. Um estudo publicado em 2015 na revista Arquivo Brasileiros de Cardiologia, da Sociedade Brasileira de Cardiologia,…
RDC- 157 – RASTREABILIDADE DE MEDICAMENTOS
AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA DIRETORIA COLEGIADA RESOLUÇÃO DA DIRETORIA COLEGIADA – RDC N° 157, DE 11 DE MAIO DE 2017 Dispõe sobre a implantação do Sistema Nacional de Controle de Medicamentos e os mecanismos e procedimentos para rastreamento de medicamentos e dá outras providências. Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso da atribuição que lhe confere o art. 15, III e IV, aliado ao art. 7º, III e IV da Lei nº 9.782, de 26 de janeiro de 1999, e ao art. 53, V, §§ 1º e 3º do Regimento Interno aprovado nos termos do…
Resolução define método para rastrear medicamentos
RDC n. 157/2017 define código de barras bidimensional como a tecnologia para captura e armazenamento de medicamentos. Nesta segunda-feira (15/5), foi publicada a Resolução da Diretoria Colegiada (RDC) de nº 157, que determina novos mecanismos e procedimentos para o rastreamento de medicamentos. No âmbito do Sistema Nacional de Controle de Medicamentos (SNCM), os rastreamentos acontecerão por meio de tecnologia de captura, armazenamento e transmissão eletrônica de dados, em produtos farmacêuticos no território nacional. O código de barras bidimensional é a tecnologia para a captura e o armazenamento de instâncias de eventos necessários ao rastreamento de medicamentos. O padrão de código…
Atrofia AME: requerido registro de medicamento novo
A empresa Biogen Brasil Produtos Farmacêuticos Ltda protocolizou, nesta terça-feira (2/5), o pedido para avaliação do Spinraza (nusinersena). O medicamento sintético novo é indicado para o tratamento da Atrofia Muscular Espinhal (AME). A Anvisa está tratando o tema com celeridade e já avalia o dossiê de tecnologia farmacêutica, um dos documentos necessários para o registro do produto. A análise de registro de um medicamento novo é uma ato complexo e baseia-se na avaliação crítica de informações legais e técnicas, como estudos pré-clínicos, estudos clínicos (fase I,II,II), dados de tecnologia farmacêutica (produção, controle de qualidade, validações analíticas, informações do fármaco e…
Anvisa tem registro recorde de medicamentos
Em três anos, a Anvisa mais que dobrou o número de registros de medicamentos e produtos biológicos e insumos farmacêuticos ativos (IFAs). No ano passado, 2016, a Agência concedeu 882 registros, contra 366 no ano de 2014. A agilização da análise desses produtos manteve um ritmo constante, com 773 novos produtos registrados em 2015. Os dados sobre registros de medicamentos e de produtos biológicos e de insumos farmacêuticos ativos (IFAs) estão publicados no Relatório de Atividades da Gerência-Geral de Medicamentos e Produtos Biológicos da Anvisa. A Gerência-Geral de Medicamentos e Produtos Biológicos (GGMED) é a área da Anvisa responsável por…
Anvisa suspende e interdita 13 lotes de medicamentos
Doze lotes de medicamentos foram suspensos e outro foi interditado pela Anvisa nesta terça-feira (2/5). Os lotes são de medicamentos de três empresas diferentes. O primeiro medicamento interditado foi o Floxicam (piroxicam), 20mg, da empresa Brainfarma. O lote interditado é o B16J2232, que traz na embalagem a validade até 10/2018. A interdição foi motivada depois que o Laboratório de Saúde Pública de Goiás verificou que a dose de piroxicam no produto estava incorreta. A ação faz parte do Programa Nacional de Verificação de Medicamentos (Proveme). A interdição é preventiva e dura 90 dias para que seja feita a contraprova. Caso…
Medicamentos da Vic Pharma são suspensos
A Anvisa suspendeu a fabricação e o comércio de 30 medicamentos da empresa Vic Pharma Indústria e Comércio Ltda. A suspensão dos produtos foi publicada no Diário Oficial da União (DOU) desta terça-feira (2/5). De acordo com uma inspeção investigativa realizada nos dias 11 e 12 de abril de 2017, uma série de não conformidades quanto às Boas Práticas de Fabricação de medicamentos foi constatada na empresa Vic Pharma. A vigilância sanitária municipal de Taquaritinga/SP, diante do cenário, havia determinado a suspensão dos medicamentos. Confira a lista completa dos produtos suspensos: Solução de peróxido de hidrogênio 3% Água oxigenada 10…
Serviços de vacinação estão em consulta pública
A Anvisa publicou nesta terça-feira (25/4) a Consulta Pública 328/17 que trata sobre os requisitos mínimos para o funcionamento dos serviços de vacinação. Esta é uma iniciativa que busca melhorar a regulamentação vigente, visando um maior controle dos riscos sanitários. A proposta é de estabelecer uma norma sanitária com requisitos mínimos para a prestação dos serviços de vacinação. Assim, os estabelecimentos que pretendem oferecer o serviço no Brasil, independentemente de sua natureza, terão os requisitos de funcionamento harmonizados. O prazo de contribuição começa no dia 02 de maio e seguirá aberto por 30 dias. A publicação da Consulta Pública 328/17…
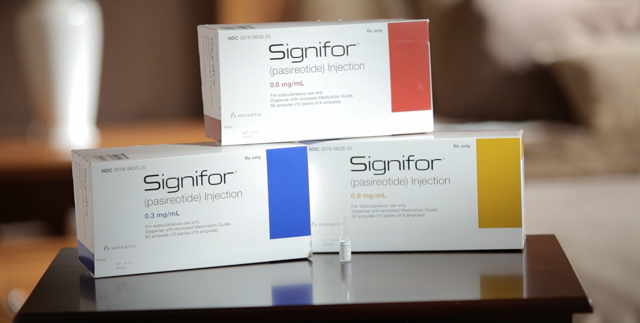
Medicamento Signifor obtém registro na Anvisa
O medicamento Signifor® LP (pamoato de pasireotida) recebeu, nesta segunda-feira (24/4), o registro da Anvisa. O produto é inédito no país e é indicado para o tratamento da acromegalia. A acromegalia é uma doença que provoca o crescimento exagerado de algumas partes do corpo como as mãos e pés. A doença também pode causar mudanças no rosto das pessoas com a projeção da mandíbula, alargamento do nariz e espaçamento exagerado dos dentes. Isso ocorre quando a glândula pituitária produz o hormônio do crescimento (GH) de forma irregular e em excesso. Além do crescimento de mãos e pés, outros sintomas da…
Abertas inscrições para seleção de gerente da Anvisa
Estão abertas, até o dia 10 de maio, as inscrições para processo seletivo para gerente-geral de Regulação e Boas Práticas Regulatórias (GGREG). Os interessados devem preencher o formulário eletrônicos disponível no link: http://formsus.datasus.gov.br/site/formulario.php?id_aplicacao=31315 O processo seletivo está aberto a profissionais com ou sem vínculo com a Administração Pública. O cargo é de livre nomeação e exoneração. Clique aqui e acesse o edital, que esclarece sobre etapas da seleção e atribuições do cargo. Quer saber as notícias da Anvisa em primeira mão? Siga-nos no Twitter (@anvisa_oficial)! Encontrou algum problema nesta notícia? Mande um e-mail para noticias@anvisa.gov.br Fonte: ANVISA
Suplementos Orient Mix são recolhidos do mercado
Foram identificadas várias propagandas e publicidades do site Orient Mix, que atribuem propriedades terapêuticas, de saúde ou funcionais não autorizadas aos alimentos. Assim, a Anvisa suspendeu, nesta terça-feira (25/04), a venda e uso de diferentes produtos fabricados pela empresa Orient Mix Fitoterápicos do Brasil Ltda. Suplemento de vitamina A à base de café verde e chá verde. EM CÁPSULAS Suplemento de vitaminas e minerais à base de chá verde. Suplemento de vitamina C à base de hibiscos e acerola. Suplemento de vitaminas e minerais à base de goji berry e acerola. Suplemento de vitaminas E minerais.…
Brasil tem 59 mil farmácias que vendem controlados
Ao todo são 59.162 farmácias e drogarias que vendem medicamentos controlados e antibióticos. Números são do SNGPC, sistema que controla a venda desses medicamentos Os medicamentos controlados são aqueles que só podem ser comprados se você apresentar uma receita especial em duas vias. Essa categoria inclui medicamentos com tarja preta e os de tarja vermelha. O Sistema Nacional de Gerenciamento de Produtos Controlados (SNGPC), criado pela Anvisa em 2007, tem hoje o cadastro de 59 mil farmácias e drogarias autorizadas a vender esse tipo de produto. No Brasil, qualquer farmácia ou drogaria que comercialize medicamentos que precisam de prescrição médica têm de enviar relatórios semanais para a Anvisa. O controle de medicamentos via SNGPC é obrigatório desde 2007 para os medicamentos de tarja preta e desde 2013 para os antibióticos (antimicrobianos) – tarja vermelha. O envio de informações pelo sistema é obrigatório tanto para farmácias…
Empresas poderão ter licença sanitária automática
Os empreendimentos que atuam com atividades sujeitas à vigilância sanitária terão um procedimento simplificado para emissão do alvará ou licença sanitária. A Anvisa aprovou nesta terça-feira (18/4) uma regra que separa as atividades econômicas entre atividades de baixo risco, de alto risco e aquelas que dependem de informações complementares. Com isso, as vigilâncias sanitárias dos municípios e estados poderão adotar procedimentos que levem em consideração o risco de cada atividade, e não somete o seu porte. A medida deve permitir que as vigilâncias sanitárias concentrem seus esforços nos empreendimentos de maior risco e agilizar a abertura de novos negócios. Como…
Lote de medicamento Atenolol é suspenso pela Anvisa
A Anvisa suspendeu nesta segunda-feira (10/4) a comercialização do lote 38736 (Val 12/2017) do medicamento Atenolol comprimido de 25mg. O medicamento genérico era fabricado pela empresa Vitamedic Indústria Farmacêutica Ltda e o lote, agora, se encontra suspenso. De acordo com laudo emitido pela Fundação Ezequiel Dias/FUNED, o lote do medicamento para hipertensão arterial 38736 apresentou resultado insatisfatório no ensaio de dissolução (valores de dissolução abaixo da especificação sanitária). Assim, determinou-se que a empresa Vitapan promovesse o recolhimento do estoque existente no mercado, relativo ao lote do genérico. Clorexidina suspensa Outra medida sanitária também publicada no Diário Oficial da União…
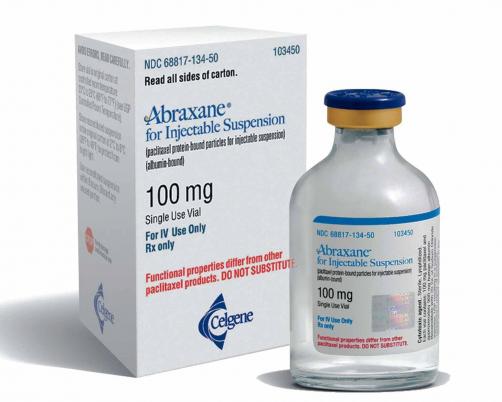
Aprovado novo medicamento para câncer de pâncreas
O medicamento novo ABRAXANE® (paclitaxel ligado à albumina) foi aprovado pela Agência Nacional de Vigilância Sanitária (Anvisa), nesta segunda (10/4). A autorização foi para a forma farmacêutica pó liofilizado para suspensão injetável, na concentração de 100 mg. Câncer no pâncreas O Abraxane é indicado para tratamento em primeira linha de pacientes com adenocarcinoma de pâncreas metastático, que é uma doença rara de comportamento agressivo e alta taxa de mortalidade. O novo medicamento será fabricado pela empresa Abrais BioScience, de Phoenix, EUA. No Brasil a detentora do registro é a empresa Celgene Brasil Produtos Farmacêuticos Ltda., localizada em Vargem Grande Paulista,…
Maxinutri e Ultrafama Saúde têm propagandas suspensas
A Anvisa suspendeu todas as publicidades que atribuam propriedades de saúde não autorizadas aos alimentos fabricados pelas empresas Ultrafarma Saúde Ltda e Maxinutri Laboratório Nutracêutico EPP. As medidas de suspensão foram publicadas no Diário Oficial da União (DOU) nesta segunda-feira (03/04). As alegações de propriedades terapêuticas ou funcionais somente podem ser feitas em alimentos registrados, quando estes cumprem com as diretrizes sanitárias. A Anvisa, após receber os pedidos de registro sanitários, realiza testes de comprovação de propriedades funcionais ou de saúde estabelecidas pela atual legislação afim de assegurar a veracidade das alegações terapêuticas dos produtos. Confira as resoluções que suspenderam…